ニュースリリース
ニュースリリース

2025.12.26
リポビタンDの新たなブランドプロモーション 「リポビタンDays」を始動!

2025.12.12
2025年度上原記念生命科学財団 上原賞受賞者及び各種助成金受領者決定のお知らせ

2025.12.01
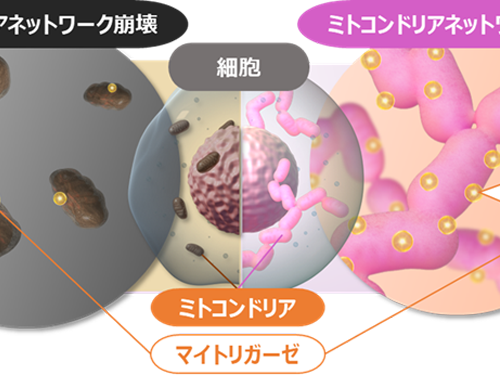
大正製薬株式会社 会社人事
2025.11.27
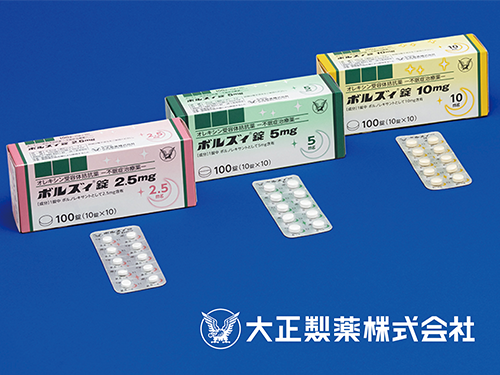
「ボルズィ®錠2.5mg, 5mg, 10mg」の発売について

2025.11.19
「ファイト イッパーツ! 応援キャンペーン2025冬」実施

2025.11.18
「リポビタンD クリスマス限定ボトル2025」数量限定、通販限定

2025.11.17
「VICKS × ちいかわ コラボ企画品」発売!

2025.10.31
秋冬の人気商品『トリニティーライン モイスト クリーム』数量限定発売

2025.10.22
「男子ラグビーワールドカップ2027オーストラリア大会」 オフィシャルサプライヤーに就任

2025.10.15
希望小売価格改定に関するお知らせ

2025.10.02
大正製薬株式会社 会社人事

2025.10.02
大正製薬、PGA TOURと オフィシャルマーケティングパートナーシップ契約を締結!

2025.10.01
大正製薬がドラッグストアでの取り扱いを開始 「VITAL PROTEINS®」発売!

2025.10.01
あの「ヘパリン類似物質」と「プラセンタエキス」配合の薬用シートマスクが再登場
2025.09.24
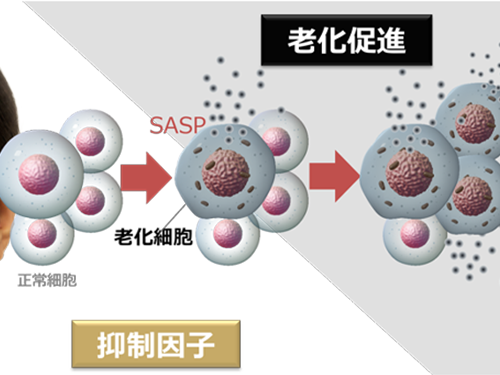
老化の連鎖を制御 ~肌老化を加速させるSASPの抑制因子を特定~

2025.09.16
大正製薬株式会社 会社人事

2025.09.16
大正製薬ホールディングス株式会社 会社人事

2025.09.02
『トリニティーライン オイル エッセンス』ビッグボトル100mL数量限定発売

2025.08.25
「リポにじ応援祭」キャンペーン実施

2025.08.21
「プロ野球ドラフト会議 supported by リポビタンD」 特別協賛決定!

2025.08.07
大正製薬×よみうりランド お客様参加型の避難訓練を開催

2025.07.25
プロゴルファー畑岡奈紗選手とのスポンサー契約を締結
2025.07.24
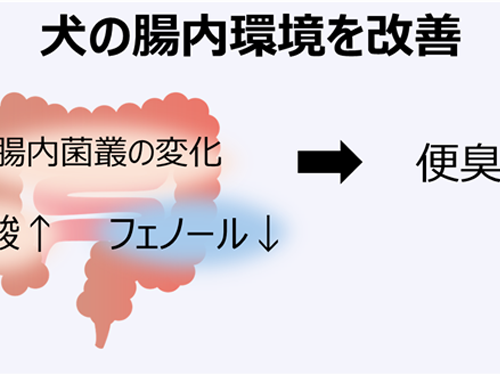
ビフィズス菌G9-1と乳酸菌KS-13が 犬の腸内環境を改善することを確認
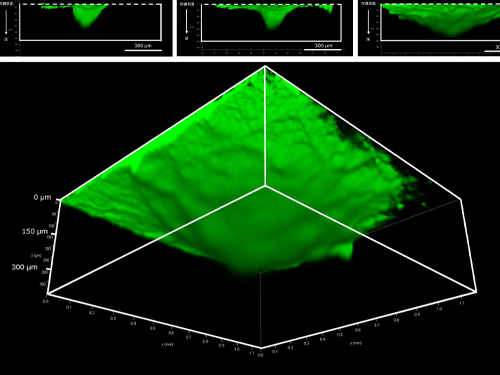
2025.07.23
ヒアルロン酸Naマイクロニードルによる皮内深くに成分を届ける性能を3D可視化

2025.07.14
「ヴイックス ヴェポラッブ」販売終了のお知らせ

2025.06.30
オレキシン受容体拮抗剤「ボルノレキサント水和物」の 第Ⅲ相臨床試験結果を発表

2025.06.30
すっきりライチ風味の経口補水液 「大正 経口補水液」新発売!

2025.06.24
「ファイト イッパーツ!応援キャンペーン2025夏」実施

2025.06.23
ラグビーファン待望の応援ボトル限定発売!
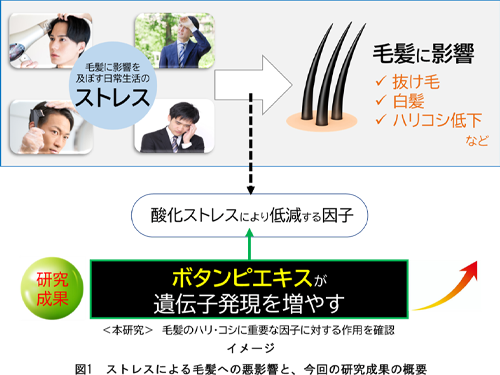
2025.06.05
毛髪への悪影響を軽減させる可能性

2025.06.04
大正製薬株式会社 会社人事

2025.06.04
大正製薬ホールディングス株式会社 会社人事

2025.06.04
リポビタンDチャレンジカップ2025応援キャンペーン開催!

2025.06.02
シワ改善先行美容液『ザ マイトル エッセンス』が累計販売数33万本突破!
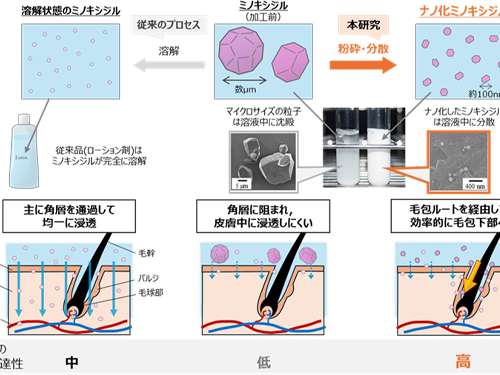
2025.06.02
ナノ化ミノキシジルによる 早い発毛効果とそのメカニズムを解明

2025.05.26
酷暑を乗り切る!夏の疲労回復に!「リポビタンクール」新登場

2025.05.16
リポビタンがギネス世界記録™を更新

2025.05.14
ケイン・コスギさん出演、「リポビタンD」新WebCM 公開!

2025.05.13
アライの新CMキャラクターに、八嶋智人さんを起用

2025.05.07
ファイトの日”に再び挑む!リポビタン、ギネス世界記録™に挑戦!

2025.04.22
リポビタンアイススラリー Sportsに「ソルティライチ風味」(無果汁)新登場!

2025.04.16
大正製薬、老化研究の最前線へ - 「エピクロック®共創プロジェクト」に参画-

2025.04.08
手軽に、美味しく、自分らしく!「リポビタンゼリーVC」新発売!

2025.04.02
美の常識に挑む!大正製薬、最新エイジング研究公開!
2025.03.31
企業従業員の健康管理のため、「内臓脂肪減少プログラム」を開始

2025.03.25
運送業者を対象とした睡眠に関する実証実験を株式会社リクサスと共同で実施

2025.03.19
「OTC販売機を用いた第2回一般用医薬品販売の実証」を開始
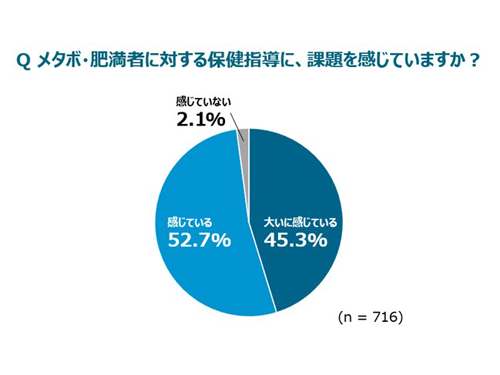
2025.03.04
【実態調査】メタボ・肥満に対する特定保健指導

2025.02.28
大正製薬株式会社 機構改革・会社人事

2025.02.28
【採択者決定】第66回リバネス研究費「&タウリン賞」

2025.02.18
【新発見】 涙で流されにくく、べたつきを抑えた抗菌点眼剤技術

2025.02.17
~1本でシミ原因もシワ原因もどちらも防ぐ、「最強レベル」薬用美白UV~

2025.02.14
「リポビタンDXと元気な朝(やつ)に会いに行く!」キャンペーン実施

2025.02.13
見た目の衰えを左右する「乾燥」と「結合型セラミド」の関連性を新解明

2025.02.12
「子どもたちのみらいのために 未来応援プロジェクト2024」寄付のお知らせ

2025.02.06
「ボルノレキサント水和物」に関する販売権許諾契約の締結について

2025.02.05
『クリニラボ マイクロニードルパッチ』シリーズ拡大!

2025.02.03
希望小売価格改定に関するお知らせ

2025.01.31
「リポビタンDチャレンジカップ2025」ラグビー日本代表戦に特別協賛、冠スポンサーに決定

2025.01.27
重炭酸入浴剤『贅温(zeion)』新発売

2025.01.08
新年から運試し!プレミアムなラグビーグッズをゲットしよう!

2025.01.07
「リポビタンD バレンタイン限定ボトル2025」数量・期間限定発売

2025.01.06